terça-feira, 9 de dezembro de 2014
O Cálcio
O Cálcio é um elemento químico de número atómico 20 e massa atómica 40.
É um metal alcalino-terroso, logo pertencente ao grupo 2 e ao 4º Período da Tabela Periódica. O seu raio atómico é 194 pm.
É um metal mole e maleável que arde com chama vermelha e forma óxido de cálcio e nitreto.
É o quinto elemento em abundância na crosta terrestre (1,6% em massa)
O cálcio tem seis isótopos estáveis, dos quais o Ca-40 é o mais abundante (97%).
Reação dos metais com a água
Os metais que reagem com água são os metais alcalinos, ou seja, os metais da família 1 da Tabela Periódica, também alguns metais alcalinoterrosos, pertencentes à família 2 (Ca, Sr, Ba e Ra); e outros metais, como o magnésio (Mg), o ferro (Fe) e o zinco (Zn).
Esses metais deslocam o hidrogênio da água e, além de produzirem gás hidrogênio, produzem também o hidróxido (base) correspondente. Um esquema genérico desse tipo de reação é mostrado abaixo, onde Me corresponde ao metal:
Me + H2O → Me(OH) + H2
A reatividade dos metais alcalinos e alcalino-terrosos aumenta ao longo do grupo, pois como os eletrões se encontram menos próximos do núcleo saiem com mais facilidade.
Famílias dos elementos químicos
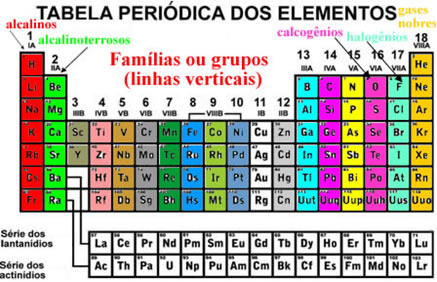
Grupo 1 - metais alcalinos
Grupo 2 - metais alcalino-terrosos
Grupo 17 - Halogéneos
Grupo 18 - Gases nobres, raros ou inertes
Nos elementos representativos:
O número do grupo
 corresponde ao número de eletrões de valência
corresponde ao número de eletrões de valênciaO número do período
 corresponde ao número de níveis de energia preenchidos
corresponde ao número de níveis de energia preenchidosLogo se o elemento químico se encontra no grupo 1 tem 1 eletrão de valência e se encontra-se no grupo 15 tem 5 eletrões de valência.
Se o elemento químico se encontra no 3º Perído, encontra-se distribuido em 3 níveis de energia
-Ao longo de um grupo, o raio atómico aumenta, uma vez que está a aumentar o nº de
níveis de energia e os electrões de valência vão sendo distribuídos cada vez mais longe
do núcleo.
-Ao longo de um período, o raio atómico diminui, embora os átomos possuam o
mesmo número de níveis de energia, aumenta o número de protões, e consequentemente
a carga nuclear, fazendo com que os electrões sejam cada vez mais atraídos pelo núcleo.
Isto faz com que aumente a atracção electrostática (núcleo-electrões), havendo uma
maior contracção da nuvem electrónica, diminuindo o tamanho do átomo.

Elementos representativos e de transição

Elementos representativos: Grupos 1,2,13,14,15,16,17,18
Elementos de transição: Grupo 3 ao grupo 12
Elementos de transição internos: Família dos Lantanídeos e dos Actínideos
Distribuição eletrónica
Regras:
 Os eletrões distibruem-se por níveis de energia (n)
Os eletrões distibruem-se por níveis de energia (n)
 A distribuição inicia-se ao nível de energia mais baixo (n=1)
A distribuição inicia-se ao nível de energia mais baixo (n=1)
 O número máximo de eletrões por nível de energia é dado pela expressão: 2n2 chamada de equação de rydberg.
O número máximo de eletrões por nível de energia é dado pela expressão: 2n2 chamada de equação de rydberg.
Exemplo:
2x42 = 2x16 = 32
 Quando o 1º nível está totalmente preenchido ( com 2 eletrões ) passa-se para o nível seguinte (n=2). E assim sucessivamente
Quando o 1º nível está totalmente preenchido ( com 2 eletrões ) passa-se para o nível seguinte (n=2). E assim sucessivamente
 O número máximo de eletrões no último nível de energia é 8 (exceção para o n=1, em que o máximo é 2).
O número máximo de eletrões no último nível de energia é 8 (exceção para o n=1, em que o máximo é 2).
Os eletrões a terem em conta na distribuição eletrónica são os eletrões de valência.
Eletrões de valência - são os eletrões do último nível de energia.
 Os eletrões distibruem-se por níveis de energia (n)
Os eletrões distibruem-se por níveis de energia (n) A distribuição inicia-se ao nível de energia mais baixo (n=1)
A distribuição inicia-se ao nível de energia mais baixo (n=1) O número máximo de eletrões por nível de energia é dado pela expressão: 2n2 chamada de equação de rydberg.
O número máximo de eletrões por nível de energia é dado pela expressão: 2n2 chamada de equação de rydberg.Exemplo:
2x42 = 2x16 = 32
 Quando o 1º nível está totalmente preenchido ( com 2 eletrões ) passa-se para o nível seguinte (n=2). E assim sucessivamente
Quando o 1º nível está totalmente preenchido ( com 2 eletrões ) passa-se para o nível seguinte (n=2). E assim sucessivamente O número máximo de eletrões no último nível de energia é 8 (exceção para o n=1, em que o máximo é 2).
O número máximo de eletrões no último nível de energia é 8 (exceção para o n=1, em que o máximo é 2).Os eletrões a terem em conta na distribuição eletrónica são os eletrões de valência.
Eletrões de valência - são os eletrões do último nível de energia.
Formação de iões

Num átomo o número de eletrões é igual ao número de protões, logo a carga dos átomos é neutra.
Iões positivos:
Átomos que perdem eletrões formam iões positivos, ou catiões, pois o número de protões, partículas positivas, é maior do que o número de eletrões, partículas negativas.
Perde 1 eletrão
 Ião monopositivo
Ião monopositivoPerde 2 eletrões
 Ião dipositivo
Ião dipositivoPerde 3 eletrões
 Ião tripositivo
Ião tripositivoIões negativos:
Átomos que ganham eletrões formam iões negativos, ou aniões, pois o número de eletrões, partículas negativas, é maior do que o número de protões, partículas positivas.
Ganha 1 eletrão
 Ião mononegativo
Ião mononegativoGanha 2 eletrões
 Ião dinegativo
Ião dinegativoGanha 3 eletrões
 Ião trinegativo
Ião trinegativoUm átomo transforma-se num ião de forma a que o último nível de energia tenha 8 eletrões, tendo assim máxima estabilidade.
Nuclido de um átomo
À seguinte representação esquemática do átomo dá-se o nome de Nuclido do átomo.
 |
| X - Símbolo do elemento químico Z - Número atómico do elemento químico A - Número de massa do átomo |
Exemplo:
 |
| Nuclido dos 3 átomos de hidrogénio |
domingo, 30 de novembro de 2014
Isótopos
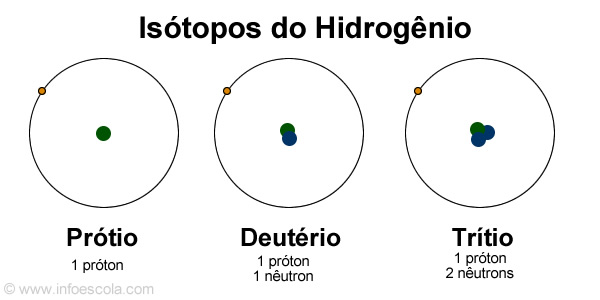
Os 3 átomos têm o mesmo número de protões, logo pertencem ao mesmo elemento químico, estes são isótopos.
O que são isótopos?
Isótopos são átomos do mesmo elemento químico, ou seja, têm o mesmo número atómico mas diferente número de massa.
domingo, 5 de outubro de 2014
Evolução do modelo atómico
Com o passar do tempo, a evolução da tecnologia, o aperfeiçoamento da ciência e o aparecimento de novos cientistas os modelos atómicos evoluiram. Foi possível entender o que constitui a matéria, prever determinados comportamentos dos materiais, entender e manipular a radioatividade e produzir diversos produtos.
As teorias mais estudas dos modelos atómicos foram:
-Modelo atómico de Dalton (1803) - O modelo indivisível:

Segundo Dalton:
- Os átomos eram partículas pequenas, indivisíveis e indestrutíveis.
- Os átomos que pertencem a elementos químicos diferentes, apresentam massas diferentes, assim como propriedades químicas diferentes.
- Os compostos são associações de átomos de elementos químicos diferentes.
- Cada elemento químico seria constituído por um tipo de átomos iguais entre si, e quando combinados, os átomos dos vários elementos formariam compostos novos.
-Modelo atómico de Thomson (1897) - Primeiro modelo divisível:

Segundo Thomson:
- Os átomos eram constituídos por eletrões, particulas negativas, ou seja, não eram indivisiveis.
- Os átomos eram corpúsculos de carga positiva, onde se encontravam os eletrões, carga negativa, em número suficiente para que a carga total do átomo fosse nula.
-Modelo atómico de Rutherford ( sec. XX):

Segundo Rutherford:
- A maior parte do átomo era espaço vazio, estando a carga positiva localizada no núcleo (ponto central do átomo), tendo este a maior parte da massa do átomo. Os eletrões estariam a girar em torno do núcleo.
- O átomo também era constituído por protões, partículas com carga positiva que se encontram no núcleo e mais tarde Rutherford passou a incluir os neutrões, partículas sem carga elétrica no núcleo.
“O átomo é constituído de duas regiões distintas: um núcleo ou região central que contém praticamente toda a massa do átomo e apresenta carga positiva; e uma eletrosfera, isto é, uma região ao redor do núcleo, onde os elétrons giram em órbitas circulares”.
-Modelo atómico de Bohr (1913):
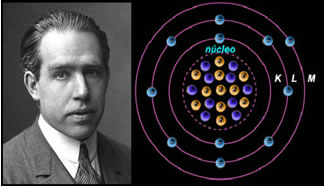
Segundo Bohr:
- Os eletrões só podem ocupar níveis de energia bem definidos, e os eletrões giram em torno do núcleo em órbitas circulares com energias diferentes. As órbitas interiores apresentam energia mais baixa e à medida que se encontram mais afastadas do núcleo o valor da sua energia é maior. Quando um eletrão recebe energia suficiente passa a ocupar uma órbita mais externa (com maior energia). Se um eletrão passar de uma órbita para uma outra mais interior liberta energia.
-Os eletrões tendem a ter a menor energia possível - estado fundamental do átomo.
-Modelo da nuvem eletrónica (atual):

No núcleo do átomo estão os protões e os neutrões, enquanto que os eletrões giram em seu redor. Na figura ao lado está representada a nuvem eletrónica de um átomo. Esta nuvem representa a probabilidade de encontrar os eletrões num determinado local do espaço.
Os eletrões de um átomo ocupam determinados níveis de energia (o número de eletrões em cada nível de energia é expresso pela distribuição eletrónica).
Os principais cientistas responsáveis por esta proposta foram Heisenberg, Schrödinger e Dirac. No entanto houve também outras contribuições importantes que permitiram que chegássemos ao modelo que hoje consideramos como válido.
domingo, 8 de junho de 2014
Refração da luz
Refração da luz - é quando um raio de luz passa de um meio para outro e a sua velocidade muda, sofrendo um desvio na sua direção de propagação.
Quanto mais o raio se aproximar da normal, maior é a densidade do meio, e assim vice-versa.

Quanto mais o raio se aproximar da normal, maior é a densidade do meio, e assim vice-versa.
O olho humano

Retina – Membrana onde se formam as imagens.
Cristalino – Lente que permite focar as imagens dos objetos na retina
Pupila – Abertura circular onde entra a luz
Como se forma um arco-íris?
1º - A luz branca do Sol é interceptada por uma gota de água da atmosfera.
2º - Uma parte da luz é refractada para dentro da gota e decompoem-se nas 7 cores do arco-íris.
3º - A luz é refletida no interior da gota e cada cor é desviada em um ângulo diferente e são refractada para fora da gota.
4º- Ao sair da gota os raios são desviados mais uma vez.

2º - Uma parte da luz é refractada para dentro da gota e decompoem-se nas 7 cores do arco-íris.
3º - A luz é refletida no interior da gota e cada cor é desviada em um ângulo diferente e são refractada para fora da gota.
4º- Ao sair da gota os raios são desviados mais uma vez.

quarta-feira, 4 de junho de 2014
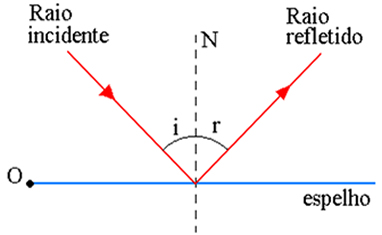
Leis da Reflexão
1 – O raio
incidente, o raio refletido e a normal no ponto de incidência estão no mesmo
plano.
2 – O ângulo
de incidência é igual ao ângulo de reflexão.
Reflexão da Luz
Reflexão
da Luz – Mudança de direção ou de sentido que ocorre quando os raios
luminosos incidem no mesmo meio.
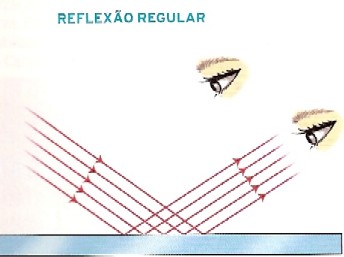
A reflexão regular ocorre numa superfície
polida. Os raios luminosos são desviados na mesma direção.
A reflexão difusa ocorre numa superfície
rugosa. Os raios luminosos são desviados em direções diferentes, pois nem todos
os raios incidem com o mesmo ângulo.
Sombra e Penumbra
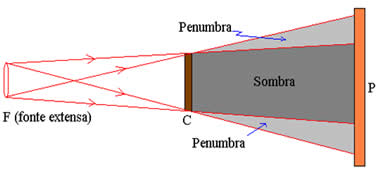
Sombra – Totalmente escura porque não recebe
luz.
Penumbra – Não é totalmente escura, apresenta
uma pequena claridade.
Meios transparentes, opacos e translúcidos
domingo, 30 de março de 2014
O ouvido humano
O ouvido humano é constituído por ouvido médio, ouvido médio e ouvido externo.

O som tem várias frequências, e só algumas são capazes de ser captadas pelo ouvido humano.
Os infra-sons e os ultra-sons são só ouvidos por alguns animais e os sons são os captados pelos humanos.

O som tem várias frequências, e só algumas são capazes de ser captadas pelo ouvido humano.
Os infra-sons e os ultra-sons são só ouvidos por alguns animais e os sons são os captados pelos humanos.
Fenómenos do Som
Eco - é a repetição de um som que foi produzido instantes antes.
O eco dá-se quando uma onda sonora atinge uma superfície dura e lisa. Isto acontece quando a onda encontra um obstáculo e é obrigada a mudar de direcção.
Para distinguir o som original do reflectido, é necessário que exista entre eles um intervalo mínimo de 0,1s.
No ar o som propaga-se com uma velocidade de 340 m/s. Como:
d = v x Δt
a distância que o som percorre é :
d = 340 x 0,1 = 34 m
Logo, para que seja possível ouvir distintamente o eco é necessário que a superfície reflectora esteja a uma distância mínima de 17 m da fonte emissora.
Reverberação - Acontece quando uma onda antige uma superfície dura e lisa a menos de 17 m, pois com esta distância não é possível distinguir o som original do reflectido, só acontece uma prolongação do som.
Refracção do som - ocorre quando o som encontra uma parede, e propaga-se através dela, chagando à sala do lado. Mas nem todo o som é refractado, e a intensidade do som que atinge a sala do lado é menor.
Ressonância - aumenta a intensidade do som.
Características do Som
O facto de conseguirmos distinguir os diferentes sons deve-se à: - Altura - Intensidade - Timbre Altura-Permite distinguir um som agudo ou alto de um som grave ou baixo. Esta característica está relacionada com o número de vibrações em cada unidade de tempo, isto é, com a frequência de vibração das ondas sonoras. Então: - quanto maior for a frequência da onda sonora, mais agudo ou alto será o som; - quanto menor for a frequência da onda sonora, mais grave ou baixo será o som. Normalmente, as mulheres têm um som mais agudo, alta frequência e os homens som mais grave, baixa frequência. Intensidade do som - permite-nos distinguir um som fraco de um som forte, é uma característica que está relacionada com a amplitude das ondas sonoras. Então - quanto maior for a amplitude da onda sonora, mais forte será o som. - quanto menor for a amplitude da onda sonora, mais fraco será o som.  Timbre - permite-nos distinguir dois sons com a mesma altura e a mesma intensidade, que são produzidos por fontes sonoras diferentes. |
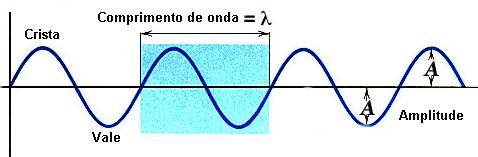
Ondas Periódicas
Ondas periódicas são as ondas geradas por fontes que executam oscilações periódicas, ou seja, que se repetem em intervalos de tempos iguais.
As ondas têm:
Cristas - os pontos mais altos de uma onda.
Vales - os pontos mais baixos da onda.
Amplitude - é a distância entre a crista e o vale da onda, ou seja, é a máxima distância que cada ponto do meio da onda apresenta em relação à sua posição de equilíbrio, seja para cima, seja para baixo.
Período (T) - é o intervalo de tempo que cada ponto do meio por onde a onda se propaga executa uma oscilação completa.
Frequência (f) - é o número de oscilações completas que cada ponto do meio no qual a onda se propaga executa, por unidade de tempo. A frequência de uma onda periódica é o inverso do seu período, ou seja:

Comprimento - é representado pela distância percorrida por uma onda no intervalo de tempo de um período.
Subscrever:
Mensagens (Atom)